Stammzellnischen: Extrazelluläre Mikroumgebungen in Gesundheit und Krankheit
Am Lehrstuhl für Zellbiologie der Leibniz Universität Hannover untersuchen wir die Wechselwirkung der blutbildenden, hämatopoetischen Stammzellen mit ihrer Mikroumgebung im Knochenmark, der sogenannten Stammzellnische. Zu diesem Zweck entwerfen wir maßgeschneiderte Biomaterialien, die es uns ermöglichen, den Einfluss physikalischer Parameter der Mikroumgebung oder ihrer biochemischen Komponenten auf hämatopoetische Stammzellen zu untersuchen.
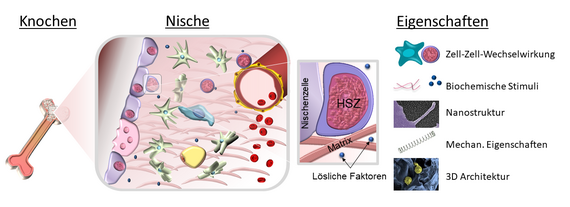
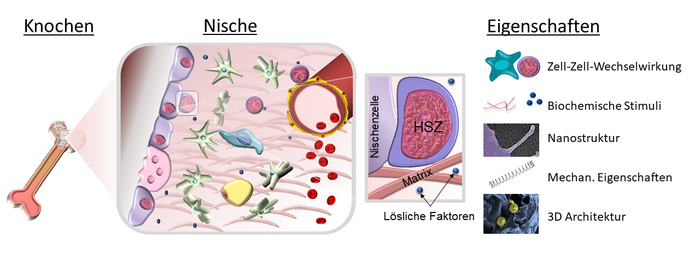
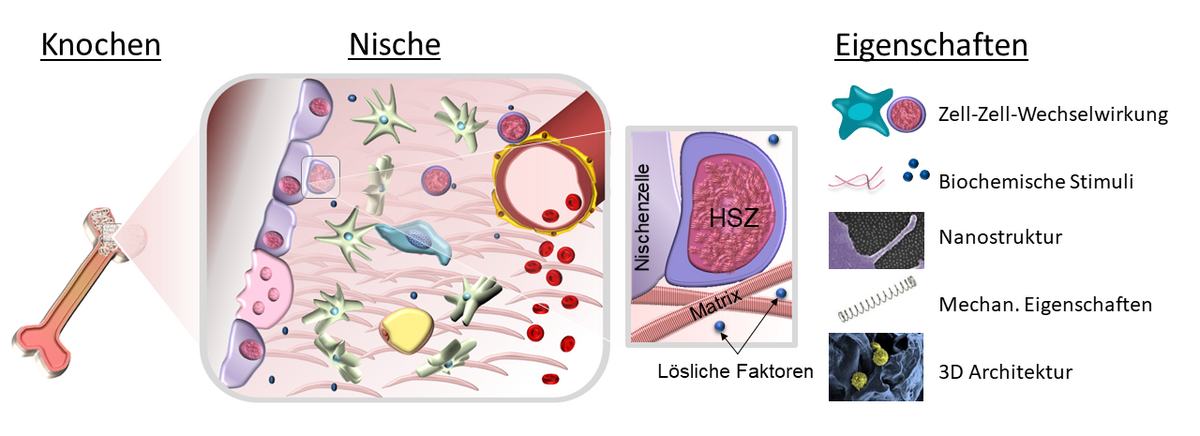
Seit Schofield den Begriff der "Nische" für das hämatopoetische System geprägt hat, wird zunehmend deutlich, dass das Konzept von Mikroumgebungen, die Zellfunktionen regulieren, auch für viele andere Organe und Gewebe gilt. Daher erforschen wir extrazelluläre Mikroumgebungen in Gesundheit und Krankheit mit einem besonderen Fokus auf der extrazellulären Matrix und Stammzell-Material-Wechselwirkungen. Hierfür verfolgen wir einen interdisziplinären Ansatz mit Expertise aus der Zellbiologie, Biochemie, Biophysik und Biomaterialwissenschaften.
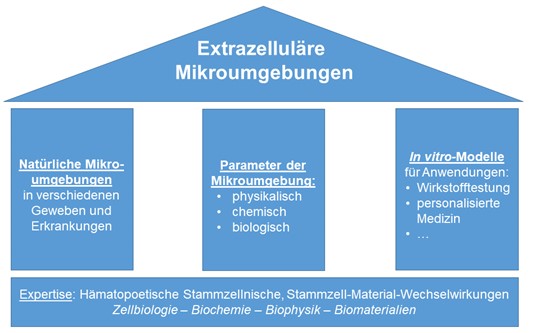
Unsere Forschung basiert auf drei Säulen:
1. Untersuchung von natürlichen Mikroumgebungen in verschiedenen gesunden und erkrankten Geweben mit einem Schwerpunkt auf Knochenmark und Knochen
2. Systematische Studien darüber, wie physikalische, biologische und chemische Mikroumgebungseigenschaften (Stamm-)Zellen beeinflussen und
3. Die Entwicklung von In-vitro-Modellen, die verschiedene Mikroumgebungen für Anwendungen wie Medikamententests nachahmen. Auf diese Art und Weise wollen wir dazu beitragen, seit langem bestehende Fragen der Zellbiologie zu beantworten, die auch für klinische und pharmazeutische Anwendungen wie die Krebsbehandlung relevant sind.


Blut und Knochen – unteilbar verbundene Gewebe in Gesundheit und Krankheit: Knochenmarkanaloga für hämatologische und muskuloskelettale Erkrankungen (bloodANDbone)
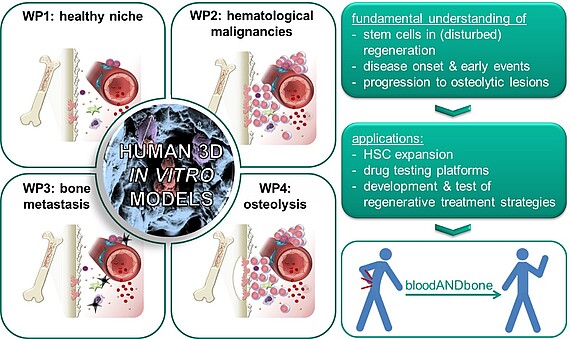

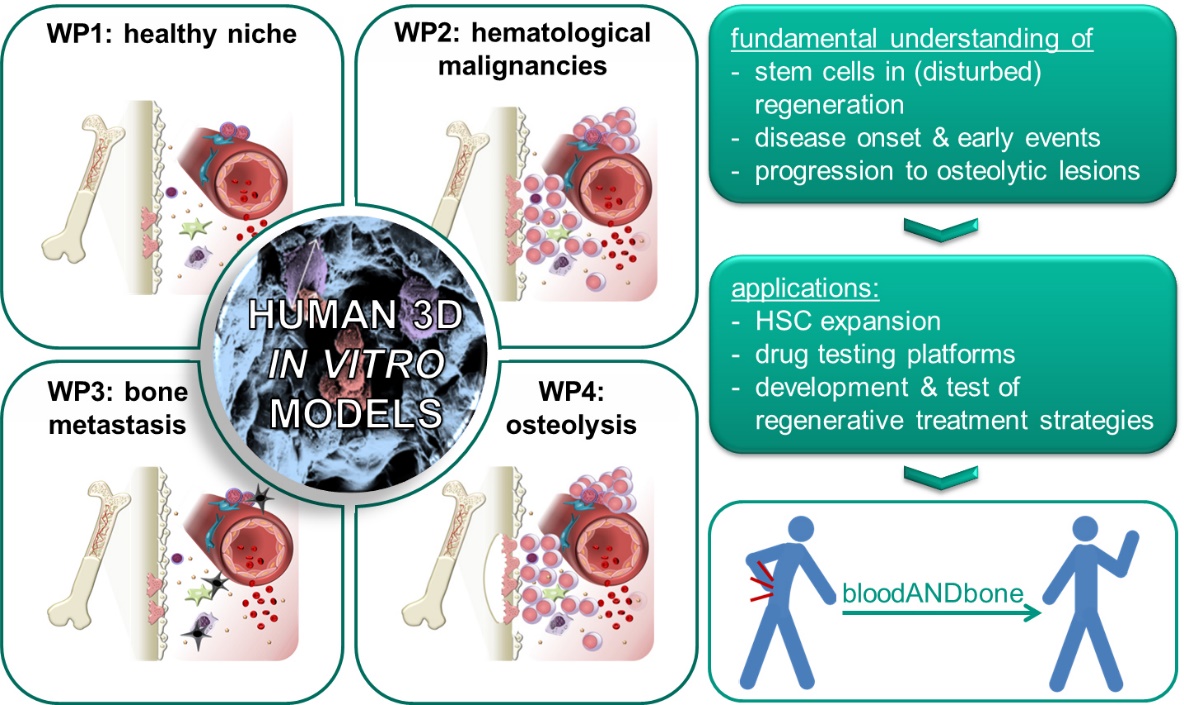
Blut und Knochen sind eng miteinander verbunden. Die intrinsischen, regenerativen Kapazitäten dieser zwei Gewebe sind in vielen hämatologischen und muskuloskelettalen Erkrankungen gestört. Die Wiederherstellung des regenerativen Potenzials durch regenerative Medizin ist der Schlüssel zur Heilung dieser Krankheiten. Multipotente Stammzellen – hämatopoietische Stammzellen (HSZ) für Blut und mesenchymale Stamm-/Stromazellen für Knochen – sind die Basis der regenerativen Kapazität beider Gewebe. Es ist weitgehend untersucht und bekannt, dass HSZs von ihrer natürlichen Umgebung im Knochenmark – einschließlich der MSZs und ihrer Abkömmlinge – beeinflusst werden. Überraschenderweise wurde umgekehrt dem Einfluss von HSZ auf ihre Umgebung bisher nur wenig Aufmerksamkeit geschenkt. Die Hypothese des ERC Starting Grant Projektes bloodANDbone ist, dass wir nur in der Lage sein werden zu verstehen, wie das regenerative Potential von Blut und Knochen in Krankheiten beeinträchtigt wird und wie es durch neue Behandlungsstrategien wieder hergestellt werden kann, wenn beide Gewebe und ihre gegenseitigen Beeinflussungen berücksichtigt werden. Um dies zu erreichen müssen wir die frühen Ereignisse des Krankheitsausbruchs und –verlaufs verstehen. Aufgrund der Beschränkungen solcher Untersuchungen in Patienten oder Tiermodellen, werden im Rahmen des Projektes humane in vitro Modelle von gesundem Knochenmark entwickelt werden, welche so induziert werden können, dass sie häufig auftretende hämatopoetische und muskuloskelettale Krankheiten, wie Leukämie, multiples Myelom und Knochenmetastasierung nachempfinden. In vorhergehenden Studien entwickelten wir vereinfachte Knochenmarkanaloga, die auf makroporösen, zellbeladenen Biomaterialien mit veränderbaren physikalischen, biochemischen und biologischen Eigenschaften basieren. Die Vielfältigkeit dieses Systems wird es uns ermöglichen, biomimetische in vitro Modelle des menschlichen Knochenmarks in Gesundheit oder Krankheit zu kreieren. Diese können wiederum genutzt werden, um die Erhaltung der regenerativen Balance des Knochenmarks in Gesundheit und während abnormaler Veränderung in verschiedenen Krankheiten zu untersuchen – eine Voraussetzung für die Entwicklung neuer regenerativer Behandlungen – und um in vitro Testsysteme für das Screening von neuen Medikamenten oder Behandlungen zu entwickeln.
Ein 3D-druckbares, biomimetisches Knochenregenerationsmaterial (PRIOBONE)
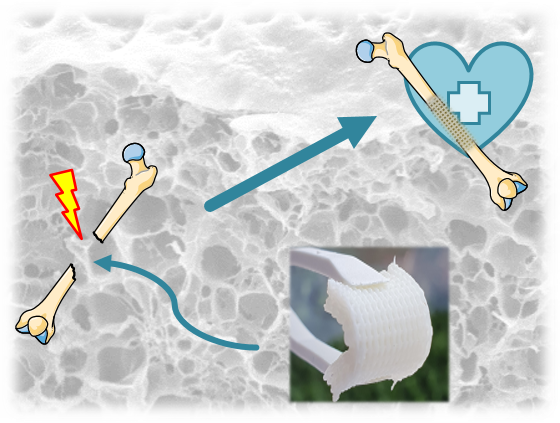


Knochendefekte von kritischer Größe heilen im Laufe des Lebens des Patienten nicht spontan und stellen eine erhebliche individuelle, gesellschaftliche und wirtschaftliche Belastung dar. Die derzeitigen Behandlungsmöglichkeiten werden durch damit verbundene Komplikationen, schlechte funktionelle oder ästhetische Ergebnisse, eine begrenzte Verfügbarkeit von Gewebe für Knochentransplantate und hohe finanzielle Kosten behindert. Weltweit werden bei mehr als 4 Millionen Operationen pro Jahr Knochentransplantate oder Ersatzmaterialien benötigt. Folglich besteht ein erheblicher klinischer und wirtschaftlicher Bedarf an neuartigen Behandlungen für Knochendefekte von kritischer Größe. In dem vom Europäischen Forschungsrat im Rahmen eines Proof of Concept Grants geförderten Projekt PRIOBONE validieren wir ein von uns neu entwickeltes, knochenmimetisches, 3D-druckbares Material für Anwendungen in der Knochenregeneration. Unser PRIOBONE-Material kann Knochen chemisch und strukturell nachahmen, ist ausgezeichnet zellverträglich, erlaubt die Ausreifung von Knochenzellen, hat einstellbare mechanische Eigenschaften und ist 3D-druckbar in jede gewünschte Form. Dies ermöglicht uns die Herstellung von Implantaten, die für die klinischen und individuellen Bedürfnisse der Patienten optimiert sind. Dazu gehört z.B. die Möglichkeit, das Material in faltbare und entfaltbare 3D-Designs zu drucken, die ein minimalinvasives Einsetzen des Materials in Defektstellen ermöglichen, wo es sich wieder ausdehnen kann. Die Verwendung etablierter Komponenten und ein ausschließlich auf Materialien basierender Ansatz ermöglichen einen schnelleren Weg zur klinischen Anwendung und behördlichen Zulassung im Vergleich zu Ansätzen, die biologische Stoffe wie Zellen oder bisher unbekannte Komponenten enthalten. Nach erfolgreicher Validierung des Materials erwarten wir, dass PRIOBONE eine kosteneffiziente, individualisierbare Alternative zu den derzeitigen Behandlungen bieten kann, die das Potenzial hat, die wirtschaftliche, individuelle und soziale Belastung durch Knochendefekte kritischer Größe deutlich zu senken.
Matrix Evolution: hierarchisch strukturierte, bioinspirierte Matrizes
Biomaterialien spielen eine Schlüsselrolle bei Anwendungen der regenerativen Medizin. Die biophysikalischen und biochemischen Eigenschaften von Materialien erschaffen spezifische zelluläre Milieus, die maßgeblich Zellverhalten und -funktion beeinflussen. Eine breite Palette an natürlichen und synthetischen Stoffen wird zurzeit im Bereich der regenerativen Medizin (Tissue Engineering) und Implantatforschung eingesetzt oder für die Anwendung erforscht. Obwohl diese Biomaterialien wichtige Anforderungen wie Biokompatibilität, Abbaubarkeit oder mechanische Stabilität bereits mitbringen, stellen sie letztendlich häufig stark vereinfachte Modelle der extrazellulären Matrix (EZM) dar. Die hierarchisch aufgebaute, stark kompartimentierte und dynamische Komplexität der realen EZM wird durch die Verwendung unstrukturierter Biomaterialien nicht erreicht.
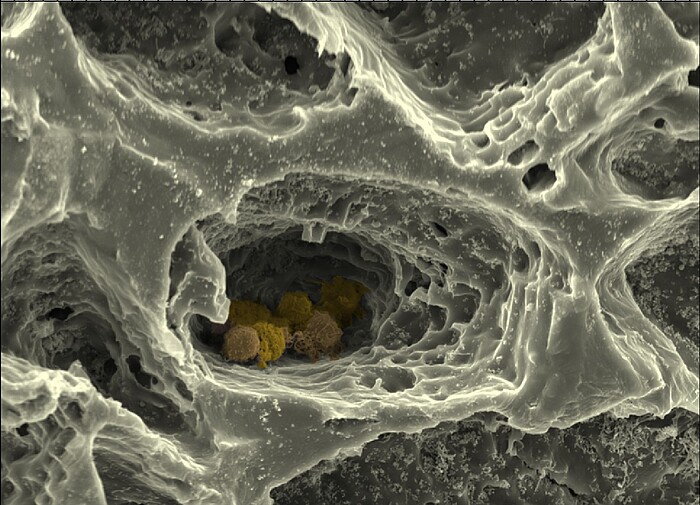




Die In-vitro-Modelle aus heute gängigen Biomaterialien bleiben damit stark vereinfacht und können die volle biologische Funktion von Gewebe nicht nachbilden. Daher werden dringend Biomaterialien benötigt, die wie die natürliche Matrix eine hierarchische Strukturierung und Komplexität aufweisen, und den Aufbau von definierten Architekturen von der Nano- bis hin zur 3D-Makroebene ermöglichen. Die natürliche EZM ist nicht nur hochstrukturiert, sondern auch hochdynamisch und wird in physiologischen Prozessen umgebaut und angepasst. Daher soll im Projekt Matrix Evolution auch dieser dynamische Aspekt nachgebildet werden, indem bioresponsive und temporal-schaltbare Elemente in die Biomaterialien eingeführt werden. Neue, bioinspirierte Matrixmoleküle und -materialien können zu einer Evolution der Matrix in der Gewebemodellierung führen, mit erheblichen Vorteilen für alle Bereiche der regenerativen Medizin und klinischen Forschung.
Im Rahmen dieses Verbundprojekts wird in der Abteilung Zellbiologie im Teilprojekt „MatrixNische“ die EZM des Knochenmarks und die Struktur des umgebenden Knochens durch Kombination verschiedener Matrixmoleküle in einem hierarchisch organisierten, biomimetischen Biomaterial nachgeahmt, das durch 3D-Druck, Elektrospinnen und der Quervernetzung von Polymeren zu Hydrogelen erzeugt wird. Diese maßgeschneiderte Matrix wird es erlauben, den kombinierten Einfluss unterschiedlicher Parameter – wie der Nanostruktur, Makrostruktur, Steifigkeit und Porosität – auf Stammzellen des Knochenmarks mit Hilfe hochauflösender Licht- und Rasterkraftmikroskopie, Einzelzellkraftspektroskopie sowie moderner biochemischer, zell- und molekularbiologischer Methoden zu untersuchen. Die hierarchisch strukturierte Matrix wird weiter als Gerüststruktur für ein aus multiplen Zelltypen aufgebautes, biomimetisches in vitro-Modell der Stammzellnische im Knochenmark verwendet, was die Analyse zellulärer Wechselwirkungen in Abhängigkeit von Matrixeigenschaften in der Nische erlaubt.
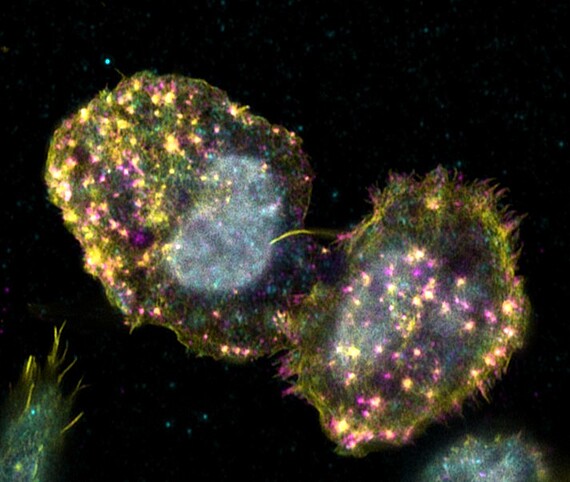
Adhäsion hämatopoetischer Stammzellen in ihrer Nische im Knochenmark
Hämatopoietische Stammzellen können ihre spezifische Funktion, die Differenzierung in alle Zellen des Blutes unter Erhaltung ihrer Stammzelleigenschaften, nur erfüllen, wenn sie die korrekten Signale aus ihrer Umgebung erhalten. Dies wird besonders deutlich, wenn man bedenkt, dass eine Kultivie-rung dieser Zellen im Labor ohne Verlust von Stammzelleigenschaften bis heute nicht uneingeschränkt möglich ist. Die benötigten Signale zum Erhalt des Stammzellcharakters erhalten die Zellen nur in ihrer Nische im Knochenmark. Folglich müssen die Stammzellen Mechanismen aufweisen, um in der Nische mittels Adhäsion verbleiben zu können. Bekannte Zelladhäsionsstrukturen, wie Fokale Adhäsi-onen oder Podosomen, konnten in den hämatopoetischen Stammzellen bisher nicht nachgewiesen werden. Lediglich die Anwesenheit von Markerproteinen bekannter Zelladhäsionsstrukturen konnten in den Zellen gefunden werden. Ziel dieses Projektes ist die Charakterisierung der Adhäsionsstruktu-ren hämatopoetischer Stamm- und Progenitorzellen mittels hochauflösender Mikroskopie. Das grund-legende Verständnis über die Adhäsionsmechanismen der hämatopoietischen Stammzellen kann dabei helfen, die Zellen künftig effektiver im Labor zu kultivieren.
Abgeschlossene Projekte
BioNanoHSZ
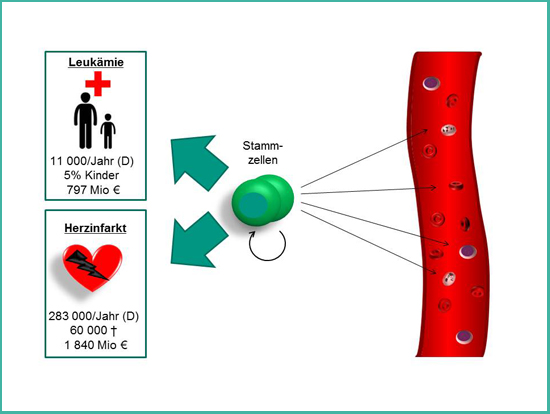


Abbildung 1: Die Stammzellen des Blutes. Hämatopoetische Stammzellen versorgen uns ein Leben lang mit frischen Blut-zellen. Sie werden seit Jahrzehn-ten zur Therapie von beispiels-weise Leukämiepatienten einge-setzt und sind viel versprechend für die Behandlung von Herz-infarktpatienten.
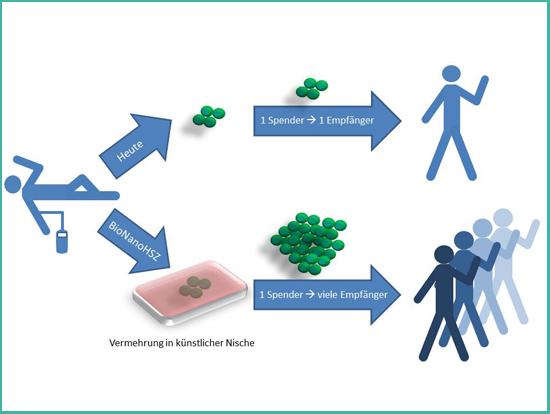


Abbildung 2: Prinzip des Projekts BioNanoHSZ.
Das Projekt BioNanoHSZ wird im Rahmen des BMBF-Nachwuchswettbewerbs NanoMatFutur auf der Grundlage des Rahmenprogramms "Werkstoffinnovationen für Industrie und Gesellschaft – WING“ wird mit insgesamt 3,18 Mio Euro gefördert (FKZ: 13N12968). Das Akronym BioNanoHSZ steht für „Biomimetische Nanostrukturierte Materialien für die Kultivierung Hämatopoetischer Stammzellen“.
Die Stammzellen des Blutes, die so genannten „hämatopoetischen Stammzellen“, befinden sich im Knochenmark und versorgen uns ein Leben lang mit frischen Blutzellen wie roten Blutkörperchen. Ist das Blutsystem erkrankt wie im Falle von Leukämie können Ärzte seit den 1960er Jahren das erkrankte Blutsystem durch ein gesundes ersetzen, indem sie die Stammzellen eines gesunden Spenders transplantieren, der Knochenmark oder Stammzellen gespendet hat. Zukünftig könnten diese Zellen auch zur Behandlung von Herzinfarktpatienten genutzt werden – einer der Haupttodesursachen in Deutschland.
Eine elegante Lösung um den Bedarf aller Patienten zu decken, die von einer Behandlung mit hämatopoetischen Stammzellen profitieren würden, wäre die Vermehrung dieser Stammzellen im Labor. Dies ist mit heutigen Methoden nicht möglich. Die einzige heute bekannte Umgebung, in der eine Vermehrung möglich ist, ist die natürliche Umgebung der Stammzellen im Körper – ihre Nische im Knochenmark. Diese ist in einzigartiger Weise für ihre stammzellerhaltende Funktion spezialisiert. Neue wissenschaftliche Erkenntnisse zeigen, dass die Materialeigenschaften der Umgebung wie die Steifigkeit oder die Strukturierung bis in den Bereich von Nanometern (also von Milliardstel Metern) Zellen entscheidend beeinflussen. Aus diesem Grund soll im Rahmen des Forschungsprojektes BioNanoHSZ erforscht werden, wie Stammzellen mit innovativen nanostrukturierten Materialien wechselwirken. Auf diesen Erkenntnissen aufbauend werden neue Materialien mit einstellbaren Materialeigenschaften entwickelt, die die natürliche Umgebung der Stammzellen nachahmen. Mit Hilfe dieser künstlich geschaffenen Stammzellnischen soll das Ziel einer Vermehrung hämatopoetischer Stammzellen erreicht werden. Das Erreichen dieses Ziels hätte weitreichende positive Konsequenzen für die Behandlung zehntausender Patienten.
Biomaterialien für die Kultivierung und gezielte Differenzierung von iPS-Zellen
Die Technik der induzierten pluripotenten Stammzellen (iPS-Zellen) wurde in den Laboren von Shinya Yamanaka in Kyoto (Japan) entwickelt. Durch das Einführen von vier verschiedenen Genen, welche für Transkriptionsfaktoren kodieren, konnte die Forschungsgruppe adulte Stammzellen in pluripotente Stammzellen umwandeln. iPS-Zellen sind in der Lage in alle adulten Zelltypen zu differenzieren sowie sich selbst unbegrenzt zu erneuern. Daher sind iPS-Zellen potentiell geeignet für Anwendungen in der regenerativen Medizin und für in vitro-Krankheitsmodelle. Bisher zeigen Zellkultursubstrate, welche zuvor mit Matrigel™ beschichtet wurden, vielversprechende Ergebnisse bezüglich Kultivierung und Differenzierung von iPS-Zellen. Zwar bietet die Anwendung von Matrigel™ eine Verbesserung im Vergleich zu Standard-Zellkulturbedingungen, jedoch zeigen sich auch erhebliche Nachteile, wie etwa Schwankungen in der Zusammensetzung und Abnahme der cytochromischen Aktivität der Zellen. Alternativ dazu werden entsprechende Biomaterialien für die iPS-Zellkultur entwickelt, durch Anpassen von biologischen und biophysikalischen Eigenschaften.
Ein Ziel dieses durch das BMWi geförderten Projektes (Förderkennzeichen ZF4397302CS7) ist die Entwicklung von vollsynthetischen, Matrigel™-nachahmenden Hydrogelen für die futterzellfreie Zellkultur, um den Einfluss von biophysikalischen und biochemischen Parametern auf iPS-Zellen zu untersuchen. Des Weiteren sollen biomimetische Gele hergestellt werden, welche sowohl die Nische der hepatischen Vorläuferzellen (HPZ), als auch die natürliche Umgebung von Leberzellen nachahmen. Diese Gele sollen dann für die Kultivierung und Differenzierung von hepatischen Vorläuferzellen, bzw. von leberzellartigen Zellen verwendet werden.
Kontakt


30419 Hannover







